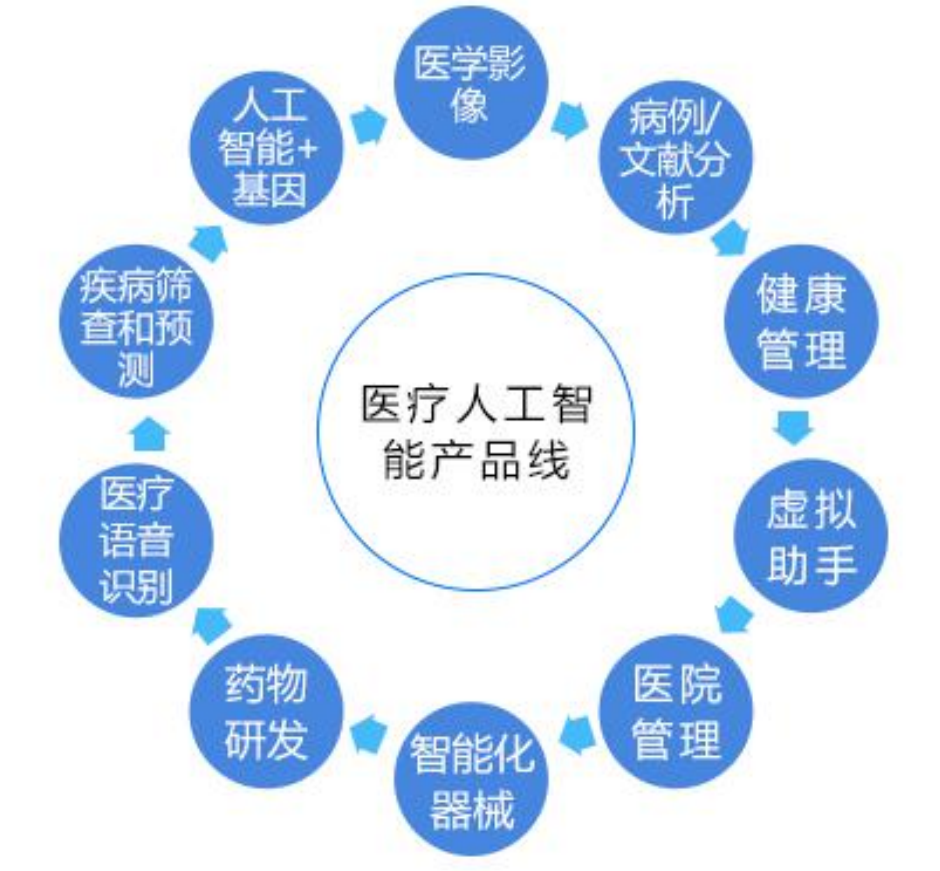
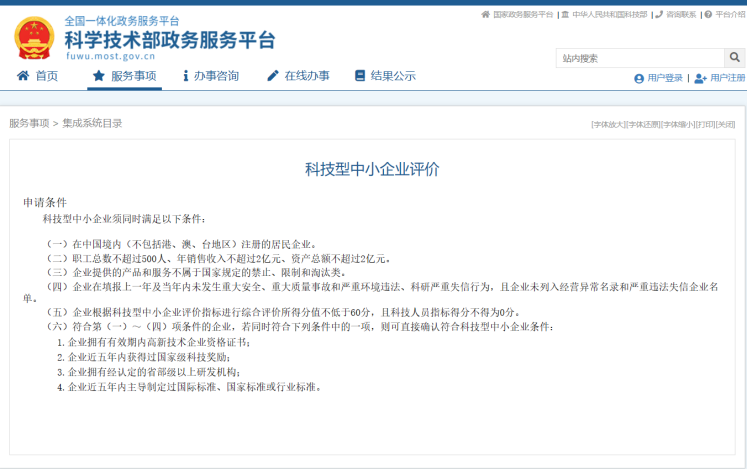
The Zhongguancun Shuimu Medical Technology Service Group was established in 2017 and is headquartered in the Beijing Yizhuang Economic and Technological Development Zone. It is committed to accelerating the process of registration and listing of innovative medical device products, and solving the "last mile" problem of industrialization for innovative medical device companies. The Group is the chairman unit of the Clinical Trial Branch of the China Association for Medical Devices Industry, the executive vice chairman unit of the Application Evaluation Branch of the China Medical Equipment Association, and the chairman unit of the Medical Device Committee of the Beijing Pharmaceutical Association.
-
 Enterprise services
Enterprise servicesAs a pioneer and leader in third-party testing and certification services in China, Zhongguancun Shuimu Medical provides global clients with one-stop inspection, testing, calibration, certification, and technical services.
-
 Water and wood incubator
Water and wood incubatorOur service capability has fully covered the supply chain of various industries, including textile and apparel, footwear and bags, baby and children's toys and home living, electronics and appliances, medical and health, food and agricultural products.