医疗器械创新之路——审评审批制度
2024-06-14 13:53:40来源 | 网络
“新质生产力”作为2024年的第一热词,指的是创新起主导作用,摆脱传统经济增长方式、生产力发展路径,具有高科技、高效能、高质量特征,符合新发展理念的先进生产力质态。它由技术革命性突破、生产要素创新性配置、产业转型升级催生而来。
对于医疗器械行业而言,发展新质生产力就必须鼓励医疗器械创新发展,今天小编将从深化审评审批制度改革角度,跟大家梳理我国创新医疗器械近年发展情况。
鼓励医疗器械创新发展是转变经济增长模式、推动产业高质量发展的要求,是改善公众健康和提高国家医疗保障水平的要求,是全面贯彻落实《医疗器械监督管理条例》的要求,是时代发展的必然。
在《医疗器械监督管理条例》(2021)中有提到新增鼓励和支持医疗器械创新的相关规定: ◆第8条 国家制定医疗器械产业规划和政策,将医疗器械创新纳入发展重点,对创新医疗器械予以优先审评审批,支持创新医疗器械临床推广和使用,推动医疗器械产业的高质量发展。国务院药品监督管理部门应当配合国务院有关部门,贯彻实施国家医疗器械产业规划和引导政策。 ◆第9条 国家完善医疗器械创新体系,支持医疗器械的基础研究和应用研究,促进医疗器械新技术的推广和应用,在科研立项、融资、信贷、招标采购、医疗保险等方面予以支持。支持企业与高等学校、科研院所、医疗机构等合作开展医疗器械的研究与创新,加强医疗器械知识产权保护,提高医疗器械自主创新能力。 ◆第12条 对在医疗器械的研究与创新方面做出突出贡献的单位和个人,按照国家有关规定给予表彰奖励。
对于创新医疗器械,需根据《创新医疗器械特别审查程序》进行申请流程,《创新医疗器械特别审查程序》于2014.2.7发布,2014.3.1实施;2018.11.2修订发布,2018.12.1实施。
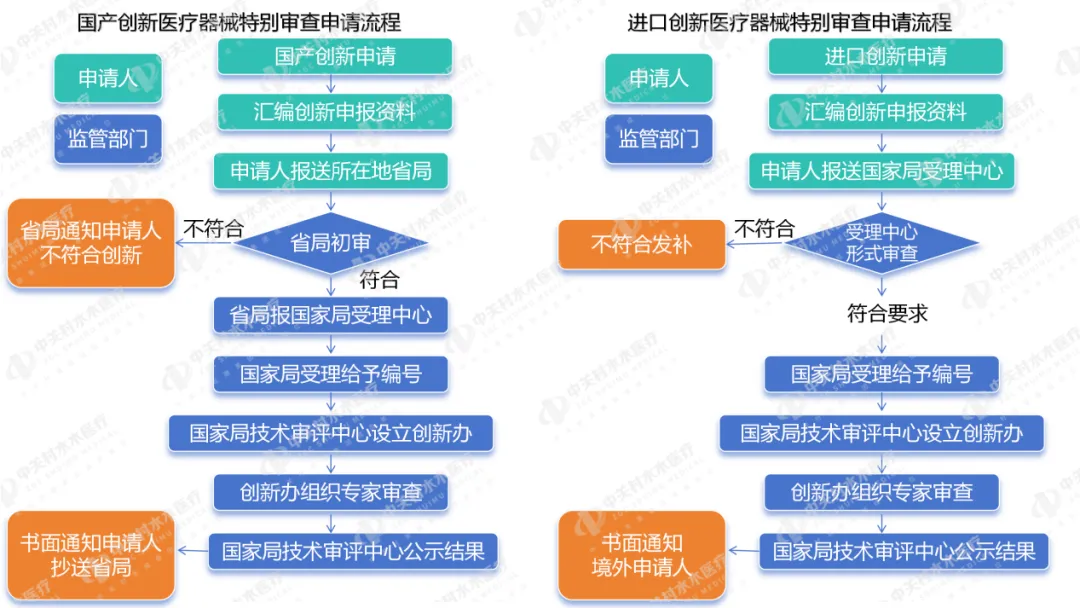
创新医疗器械审查中的常见问题主要包括专利、定型、价值三个方面,通过创新医疗器械审查的产品必须满足拥有产品核心技术的发明专利、产品已基本定型、具有显著的临床应用价值三个条件。

2023年,国家药监局共收到创新医疗器械特别审批申请466项,比2022年增加35.9%,其中69项获准进入创新医疗器械特别审查程序。
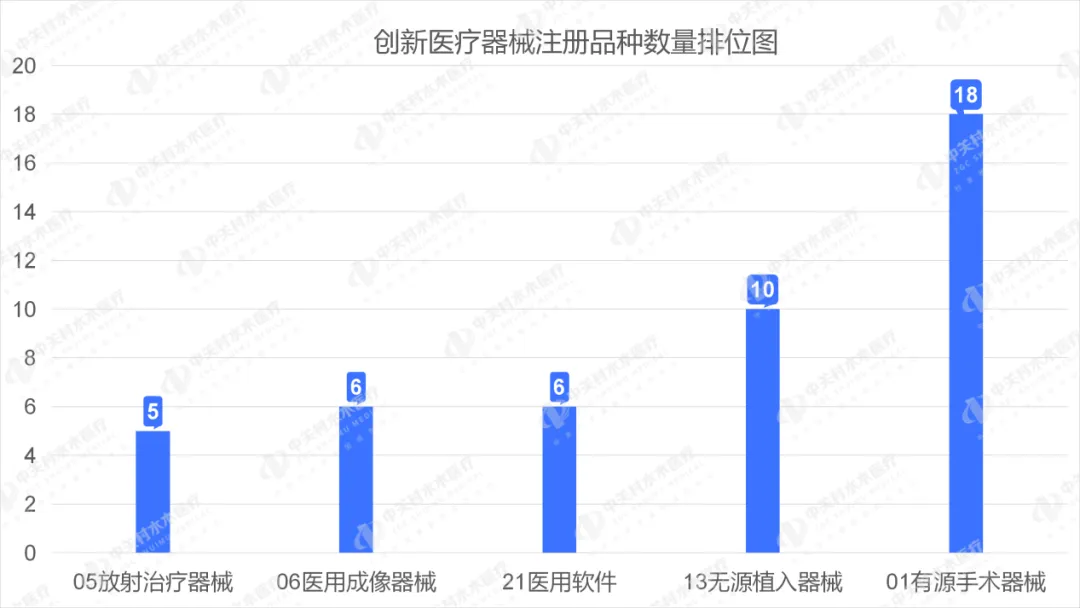
2023年,国家药监局共批准61个创新医疗器械产品上市,相比2022年增加11%。其中有源医疗器械43个,无源医疗器械16个,体外诊断试剂2个。有源手术器械、无源植入器械、医用软件、医用成像器械、放射治疗器械等高端医疗器械是2023年批准的创新医疗器械数量前五位。
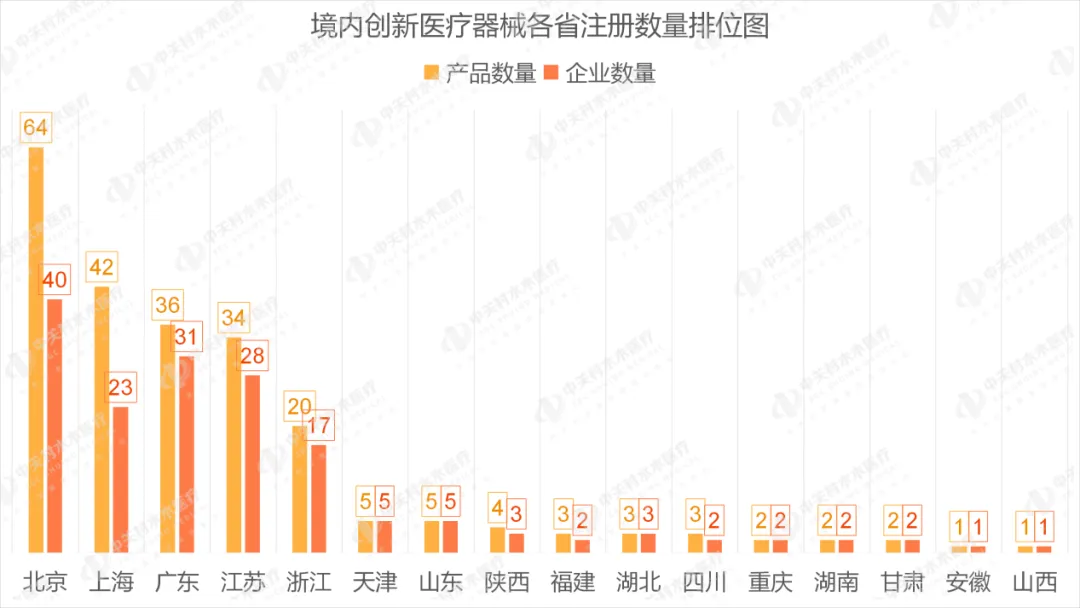
从2014年至2023年底,国家药监局收到创新医疗器械特别审批申请项目共计2781个,共批准250个创新医疗器械。其中,境内创新医疗器械涉及16个省的167家企业,进口创新医疗器械涉及5个国家的18个企业。
其中,北京有64个创新产品获批上市,数量位居全国第一;上海有42个创新产品获批上市,位居全国第二。北京、上海、广东、江苏、浙江创新医疗器械获批产品数量和相应企业数量最多,约占全部已批准的250个创新医疗器械的78.4%,但与2022年相比有所下降。
在创新医疗器械上市后,则需按照《医疗器械不良事件监测和再评价管理方法》(市场总局令第1号,自2019年1月1日起实施),进行上市后管理。
除了上述的创新医疗器械相关政策外,我国对推进医疗器械创新和高质量发展还有诸多其他措施: ◆加强部门协调,形成促进创新合力。与工信部等部门联合印发《“十四五”医疗装备产业发展规划》《医疗装备产业高质量发展行动计划(2023-2025)》等一系列文件。 ◆建立人工智能医疗器械创新合作平台(2019年7月)、生物材料创新合作平台(2021年4月),推动产学研管协同发力,促进前沿技术研究开发。 ◆与工信部联合开展人工智能、医用生物材料医疗器械创新任务揭榜挂帅,推动创新研发。 ◆针对高端医疗器械重点产品,完善前期介入机制,加大前置审评辅导力度。特别是对“中国造,全球新”的原创性产品予以全力支持。 ◆建立长三角、大湾区两个分中心和11个创新服务站作用,加强沟通指导力度。 ◆在北京、上海、广东11家医疗机构推进自制试剂试点。 ◆加强监管科学研究和国际交流合作,为医疗器械监管创新提供支持。












