药械组合知识介绍
2022-11-18 13:24:00来源 | 网络
◤ 01 药械组合产品注册申报 ◥
◎ 药械组合产品注册申报
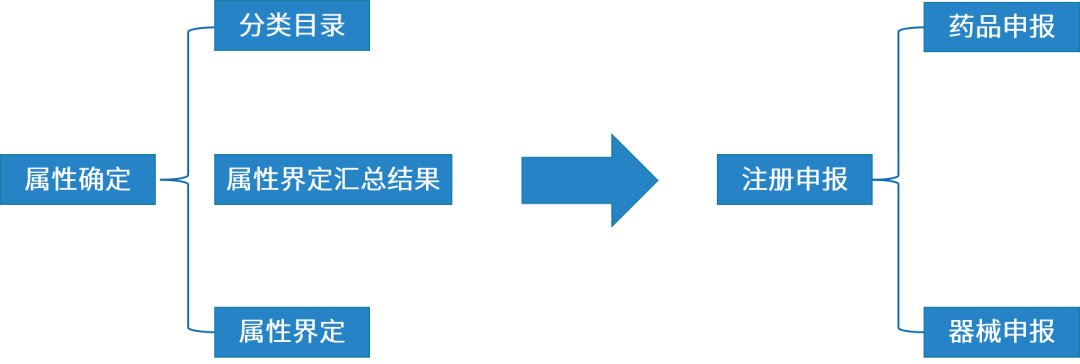
◇ 药械组合产品:
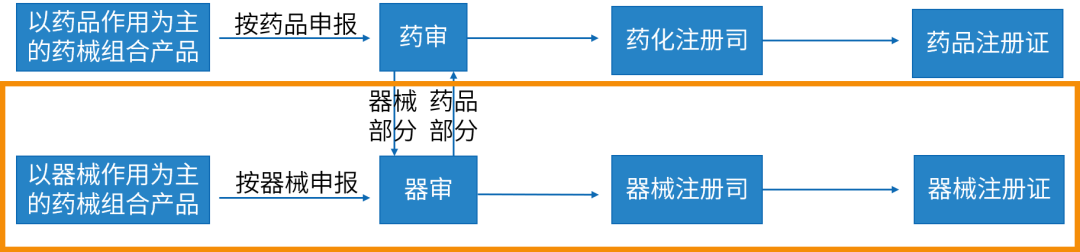
指由药品与医疗器械共同组成,并作为一个单一实体生产的医疗产品。 产品中所含药品可未单独获得上市许可。 ◇ 申报方式: 以药品作用为主的药械组合产品,需申报药品注册; 以医疗器械作用为主的药械组合产品,需申报医疗器械注册。 ◇ 申报要求: 基本要求(器械法规)+特殊要求(考虑药物)+申请表注明“药械组合产品”。 ◇ 审评审批流程:
◤ 02 药械组合相关法规公告 ◥
◎ 药械组合相关法规公告(20211216更新)
文件名称 发布日期 含药医疗器械产品注册申报资料撰写指导原则 2009年2月20日 药械组合医疗器械注册审查指导原则(征求意见稿) 2021年7月26日 关于药械组合产品注册有关事宜的通告(2021年第52号) 2021年7月26日 药械组合医疗器械药物定性、定量及体外释放研究注册审查指导原则(征求意见稿) 2021年9月16日
◎ 药械组合相关法规公告
◇ 2021年第52号通告主要变化说明
删除了2009年16号通告中“首次进口的药械组合产品,未获出口国(地区)批准上市的,以及药械组合产品中所含药品未获我国注册或未获生产国(地区)批准上市的,均不予受理”。
◤ 03 药械组合产品属性界定 ◥
◎ 药械组合产品属性界定
◇ 申报方式: 申请人通过中国食品药品检定研究院(国家药品监督管理局医疗器械标准管理中心)网站(网址:https://www.nifdc.org.cn)进入“医疗器械标准与分类管理”二级网站,点击进入“药械组合产品属性界定信息系统”,按要求上传申请材料。
◇ 申报资料清单:
一、药械组合产品属性界定申请表 二、支持性材料 (一)产品描述 (二)作用机制 (三)拟采用的使用说明书(或用户手册等) (四)组合产品各组成成分来源 (五)申请人属性界定建议及论证资料 (六)相关产品监管情况 (七)其他与产品属性确定有关的资料
◎ 药械组合产品属性界定-程序
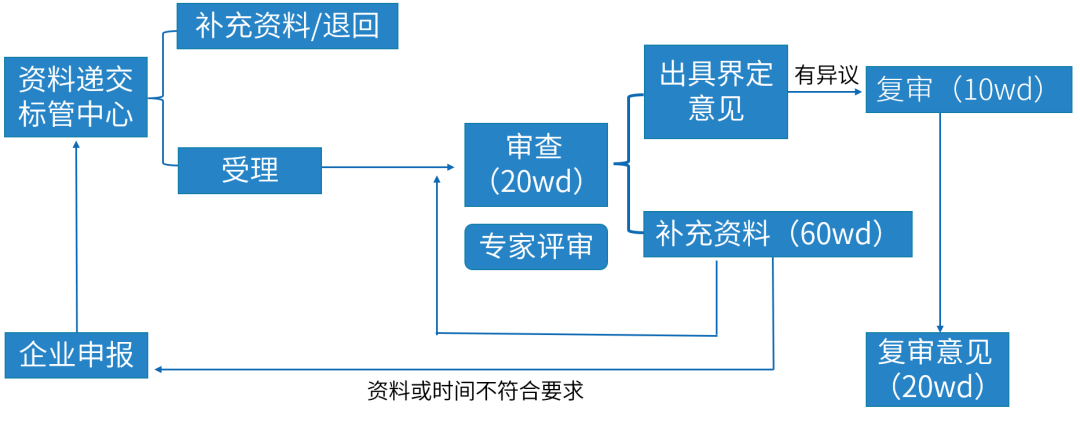
药械组合产品按照3类申报,不存在分类界定。
◎ 药械组合产品属性界定-结果汇总(20211216更新)
文件名称 | 发布日期 |
2017年至2019年7月已发布药械组合产品属性界定结果汇总 | 2019年7月24日 |
2019-2020年度药械组合产品属性界定结果汇总(2019.06.01~2020.11.30) | 2021年5月21日 |
2021年度第一批药械组合产品属性界定结果汇总(2020.12.01~2021.05.31) | 2021年7月7日 |
◤ 04 产品举例 ◥
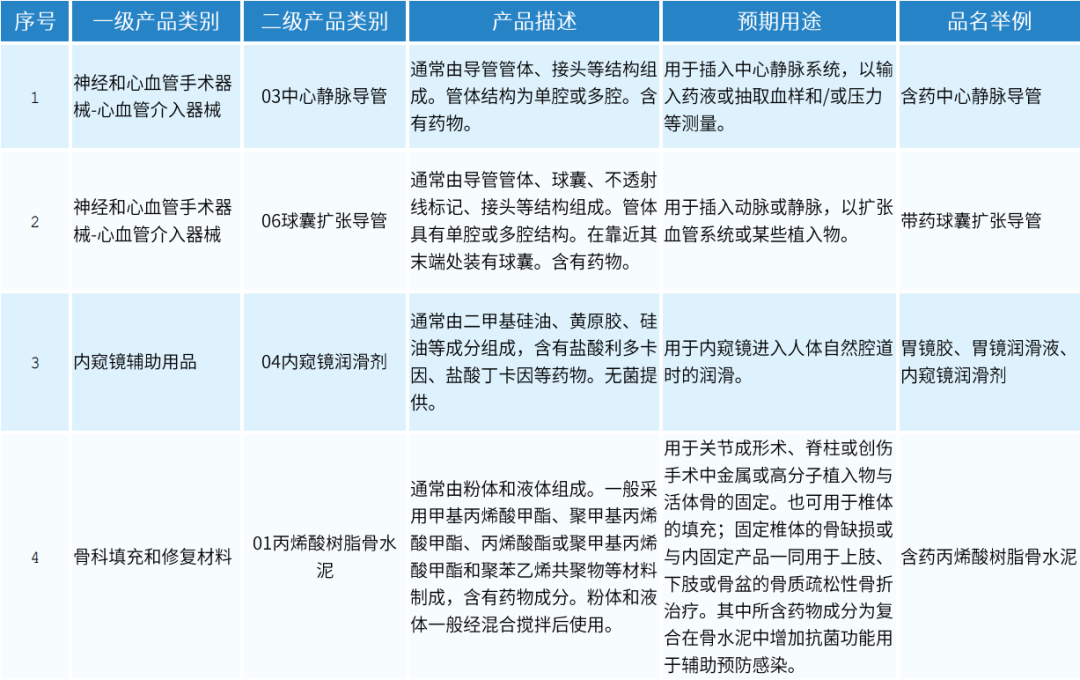
◎ 产品举例-1(分类目录)

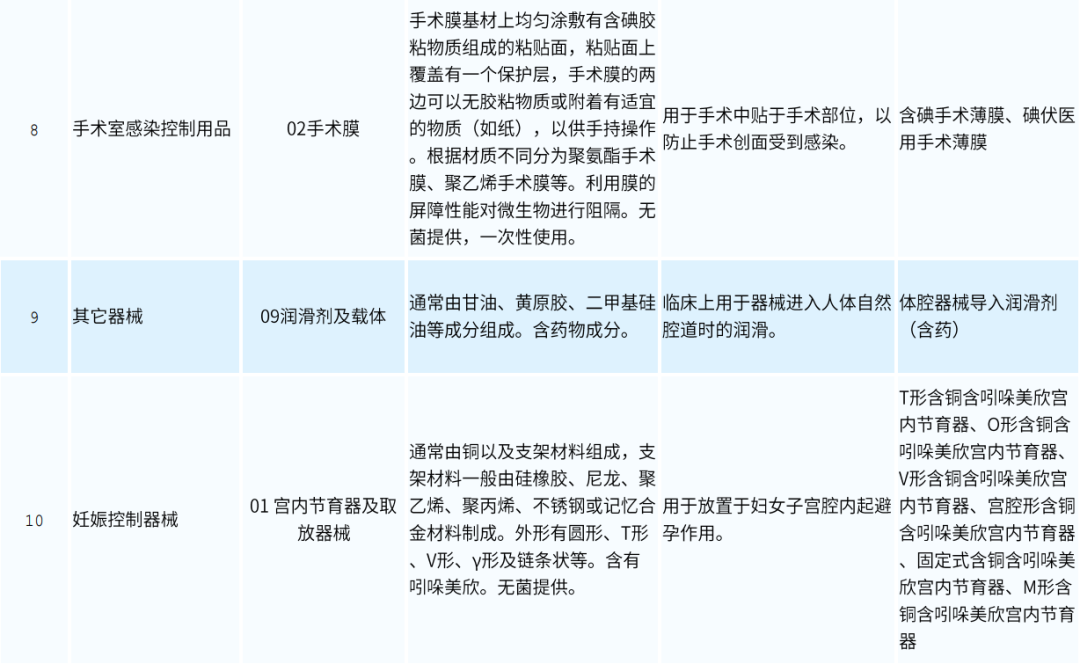
◎ 产品举例-2(透明质酸钠)


◎ 总结