附分类界定流程图|新版医疗器械产品分类界定八大看点
2024-05-24 14:27:19来源 | 网络
5月11日,国家药监局发布了《关于规范医疗器械产品分类界定工作的公告》(2024年第59号,以下简称《公告》),自2024年9月1日起施行。
相较于2017年发布的《关于规范医疗器械产品分类有关工作的通知》(食药监办械管〔2017〕127号),此次《公告》内容进行了极大的丰富。2017版文件全文不过3千字,而此次《公告》内容多达一万三千余字。接下来小编就带大家一起来看看此次《公告》有哪些值得关注的内容?
此次《公告》开篇就对“医疗器械分类界定”进行了明确的定义,从定义中我们能够看出医疗器械进行分类界定的依据,即:
(1)《医疗器械监督管理条例》
(2)《医疗器械注册与备案管理办法》
(3)《体外诊断试剂注册与备案管理办法》
(4)《医疗器械分类规则》
(5)《体外诊断试剂分类规则》
(6)相关分类界定指导原则
(7)《医疗器械分类目录》
(8)《第一类医疗器械产品目录》
(9)《体外诊断试剂分类目录》
从定义中我们同样也能够看出药品监督管理部门在进行医疗器械分类界定时的考虑因素,即:现阶段科学认知和共识,国际国内医疗器械分类实践,医疗器械的预期目的、结构组成、使用方法、工作原理,医疗器械风险程度等。
相较于旧版中的“新研制的尚未列入《分类目录》或分类界定通知等文件的医疗器械”,此次《公告》将需要进行分类界定的产品分为两大类: 一是“新研制的尚未列入《分类目录》的医疗器械” 二是“管理类别存疑的医疗器械”, 并对这两类产品进行了明确的定义。
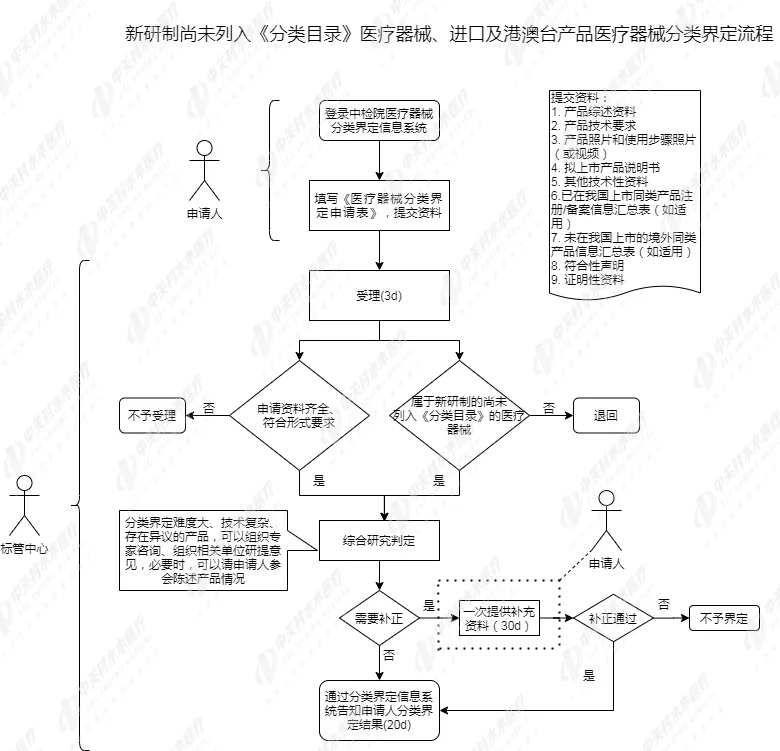
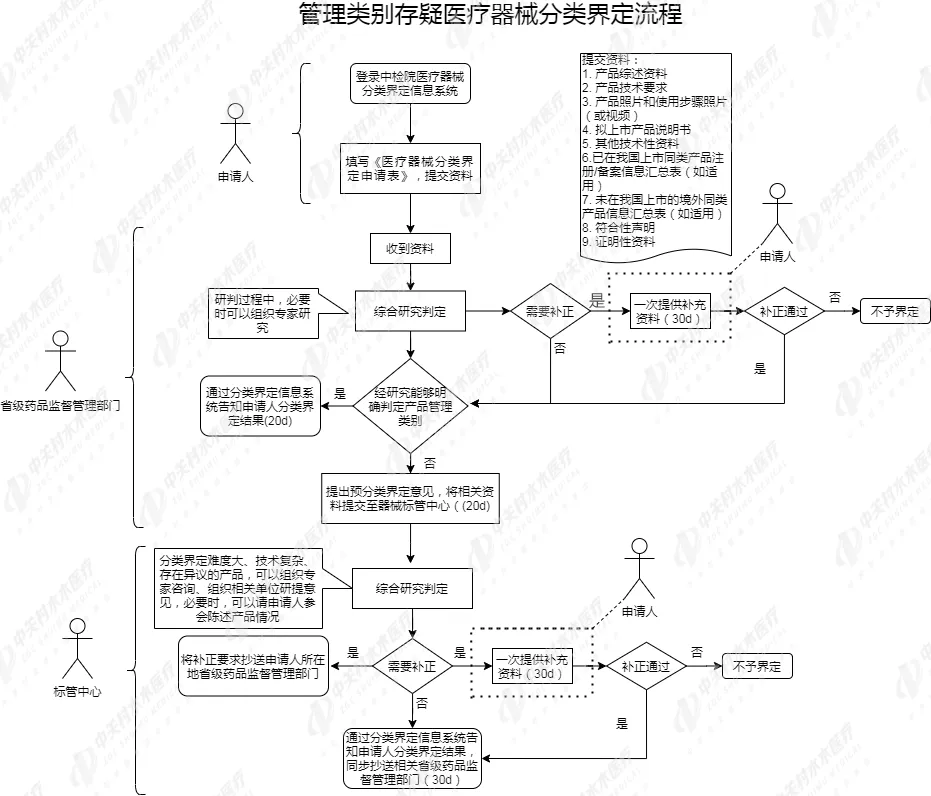
“新研制的尚未列入《分类目录》的医疗器械”和“管理类别存疑的医疗器械”分类界定申请途径有所不同,对于“新研制的尚未列入《分类目录》的医疗器械”,分类界定申请统一报器械标管中心; 对于“管理类别存疑的医疗器械”,境内产品分类界定申请先报所在地省级药品监督管理部门,省级药品监督管理部门不能确定类别的再报器械标管中心;对于进口及港、澳、台产品的分类界定,和旧版保持一致,也是报器械标管中心 针对产品分类界定结果,此次《公告》着重强调了两方面:
一是产品分类界定结果仅供申请医疗器械注册或者办理备案时使用,并且注册或者备案产品资料中的相关内容要与分类界定申请资料或者分类界定申请告知书一致,否则分类界定结果是无效的。
二是产品分类界定结果不代表对产品预期用途或者产品安全性有效性的认可,分类界定信息中产品描述和预期用途仅仅是用于判定产品的管理属性和管理类别,不代表相关产品注册或者备案内容的完整表述。
对于“其他涉及产品分类的情形”,除了旧版中的四种情况外,此次公告又完善了其他情况,总共如下:
(1)注册受理(新增)
(2)技术审评
(3)日常监管、稽查、投诉举报、信访、行政执法、刑事司法、法院案件(部分新增)
(4)突发公共卫生事件(新增)
(5)药械组合产品
(6)创新医疗器械
相较于旧版,此次《公告》规定了器械标管中心在必要时可以组织对省级药品监督管理部门回复的分类界定结果进行抽查,并且规定了对“不同省级药品监督管理部门对同一类产品分类界定意见不一致“这种情况的处理流程,即由器械标管中心组织研究确定管理类别并公开,相关省级药品监督管理部门及时修正分类界定告知书并清理规范已注册或备案产品。
此次《公告》对分类界定申请表和需提交上报的资料进行了详细的规定,申请表填写内容有产品名称、预期用途 、结构组成、产品主要风险点等等,详细内容可见《公告》附件4,需要提交上报的资料如下:
(1)产品综述资料
(2)产品技术要求
(3)产品照片和使用步骤照片(或视频)
(4)拟上市产品说明书
(5)其他技术性资料
(6)已在我国上市同类产品注册/备案信息汇总表(如适用)
(7)未在我国上市的境外同类产品信息汇总表(如适用)
(8)符合性声明
(9)证明性资料
《公告》对于申请表的填写以及需提交的每项资料都进行了具体的描述,几乎是手把手教我们如何填写申请表以及如何准备需提交的资料。
其实在去年6月份,中检院发布的《医疗器械分类界定申请资料填报指南》(试行),也对分类界定申请资料做出了详细的规定,我们也可以一并参考。
除此之外,关于分类界定的申报,北京局在去年11月份下发了《北京市医疗器械审评检查中心 医疗器械分类界定一本通》,在今年4月份也下发了《北京市医疗器械分类界定申报要求》。
最后一点,也是我们最为关注的一点,医疗器械分类界定应该如何申请?其流程是怎样的? 为方便查看,小编总结了下列分类界定工作流程,供粉丝朋友参考。