一文读懂,科技型中小企业应该如何申请500万研发资助?
2023-04-16 16:13:54来源 | 网络

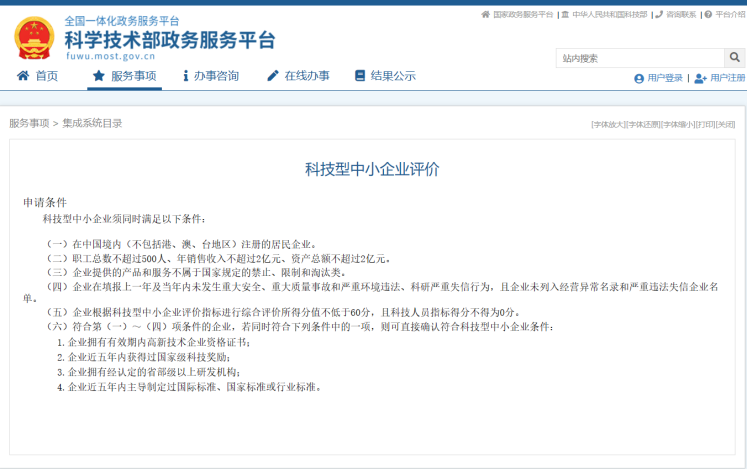
ChatGPT回答: 科技型中小企业获取研发资助的渠道包括但不限于以下几种: 政府部门提供的各类科技创新资金和政策扶持,如国家重点研发计划、国家自然科学基金、科技部创新券等。 银行和风投机构提供的风险投资和贷款支持,如创新创业投资基金、中小企业创新贷款、科技型企业股权融资等。 企业参加各类科技创新竞赛和比赛,获得奖项和资金支持。 与大型企业、高校和研究院所合作开展联合研发项目,获得合作伙伴提供的研发资金和技术支持。 申请专利、商标等知识产权,获得相关政策和资金支持。 2022年,国家新的财税政策出台,支持科技型中小企业研发。 研发费用税前加计扣除比例从75%提高到100%; 国家重点研发计划重点专项中,单列一定预算资助科技型中小企业研发。 近期,为落实“十四五”期间国家科技创新有关部署安排,国家重点研发计划启动实施“诊疗装备与生物医用材料”重点专项,2023年度项目申报指南向社会征求意见和建议(以下简称“指南”)。此专项设立“ 科技型中小企业项目”下设3个研究方向:诊疗装备科技型中小企业项目、生物医用材料科技型中小企业项目、体外诊断设备和试剂科技型中小企业项目。 “指南”中明确:申报项目的科技型中小企业应已在全国科技型中小企业信息库统一备案登记。 企业评价的流程是怎么样的呢?可在科学技术部政务服务平台进行科技型中小企业评价。 具备较强的研发能力,突出具备“四科”特征,包括: (1)具备较强的研发投入,上年或当年申报享受了研发费用加计扣除普惠政策; (2)拥有核心研发团队及一定比例的科技人员; (3)具有相关自主知识产权或专利许可等高质量科技成果,其技术指标在同行业处于领先地位; (4)技术或产品具有较大的市场潜力。 还没享受税收优惠的企业还不抓紧吗? 项目负责人 项目负责人须具有高级职称或博士学位,1963年1月1日以后出生。 你达到要求了吗? 三个方向的研究内容均为以产品为导向,支持科技型中小企业选择某个方向开展创新医疗器械的技术研究和产品研发。 发挥科技型中小企业关键核心技术攻关的优势,鼓励科技型中小企业积极探索更具创新性的新方法、新路径。 产品设计开发一般可分6个阶段,分别是策划、设计输入、设计输出、小试、中试和定型阶段。 ①策划。在立项后,根据设计需求组建设计开发团队,建立设计和开发的程序,对医疗器械的功能、外观、结构、材质、工艺、生产技术等提出设想。 ②设计输入。在前期调研的基础上,明确产品的性能、功效、使用寿命等的情况以及对人员、设备、生产环境等的要求,经相关团队审批确认后形成输入文件。 ③设计输出。根据设计输入的要求,指定所需材料和组件的技术要求或接收标准,给出产品标准、产品图纸、部件清单以及生产工艺、包装要求、检验程序等详细内容,并做好设计和开发的记录。 ④小试。在实验室开展研发和样品的试制。 ⑤中试。产品正式投产前的试验,是产品在大规模量产前的较小规模试验。 ⑥定型。配方和工艺确定,可以进入批量生产阶段。 某个方向?由企业自行提出,但是考核指标要求达到同类技术和产品的国内领先水平; 《国务院办公厅关于完善科技成果评价机制的指导意见》国办发〔2021〕26号文件期望通过创新科技成果评价方式,激发科技人员积极性,推动产出高质量成果。 因此,同类技术和产品的国内领先水平的鉴定需要开展第三方评价!!! 要求形成样机,至少开展动物实验,鼓励开展临床试验及医疗器械注册。 产品开发的一般流程包括:产品开发设计→制备样品→性能自测与评估合格→注册检验→临床试验→注册申报→产品注册证。 样机的制作处于定型之前的中试阶段,在此阶段需要确保医疗器械产品设计和开发的输出满足输入要求。包括制作样机进行试验和演示;对样机进行自测;请第三方进行检测;对文件进行评审等方面。 动物试验是采用科学、合理的评价方法开展医疗器械安全性和有效性评价的重要手段之一,属于产品设计开发中的重要研究,可为产品设计定型提供相应的证据支持。同时动物试验可为医疗器械能否用于人体研究提供支持,降低临床试验受试者及使用者的风险以及为临床试验设计提供参考。 并不是所有医疗器械均需要通过动物试验验证产品安全性和有效性,国家药监局制订了相关指导原则,对开展动物试验的必要性判定提供指导,减少动物试验研究数量,避免开展不必要的动物试验。 注册检验即为医疗器械产品的全性能试验,也称型式检验,通过验证被测产品是安全、有效的,在检测合格后方可进行临床试验或申请注册。为加强医疗器械检验工作,提升医疗器械检验机构(以下简称检验机构)的检验能力和管理水平,提高医疗器械检验工作质量和效率,根据《医疗器械监督管理条例》《检验检测机构资质认定管理办法》《医疗器械检验机构资质认定条件》及相关法律法规文件,国家药品监督管理局组织制定了《医疗器械检验工作规范》。检验机构应当具有依据国家标准、行业标准、补充检验项目和检验方法、产品技术要求等开展检验工作的能力,并具备对委托方提交的产品技术要求进行预评价的能力。 提交证明该技术和产品先进性和实用性的证明性文件,包括设计报告、分析报告、技术测试报告、第三方检测报告、查新报告等。 其他说明: 鼓励产学研医检合作(2022年度项目参与单位总数不超过2家,2023年度征求意见稿中参与单位总数不超过3家,需要注意的是不下设课题哦)
.png)
.png)
.png)












