新版《体外诊断试剂分类目录》发布后,一文看懂如何进行注册备案管理
2024-05-17 13:47:57来源 | 网络
5月11日,国家药监局发布了新版《体外诊断试剂分类目录》及其实施通告和解读,这一重磅法规引起行业热议。
除了新版《体外诊断试剂分类目录》的变化外,我们最关心的是新版《体外诊断试剂分类目录》实施后,我们如何进行注册备案,包括现有证件如何过渡以及未来如何取证,这涉及到我们现有证件的合规期限以及我们为满足新法规所带来的工作量。
接下来小编针对如何进行注册备案的问题谈一谈自己的看法。
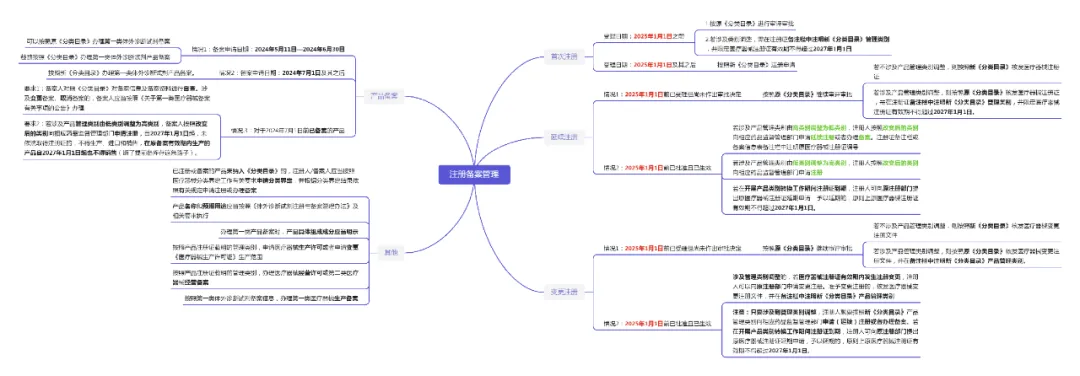
根据通告和解读,对于已经取得证件的产品,产品管理类别由高类别调整为低类别,是比较好操作的,若产品由三类降为二类,可以在延续时向省药品监督管理部门申请延续注册;若产品由二、三类降为一类,可以向市药品监督管理部门申请办理备案,在新取得的注册证备注栏或备案信息表备注栏中会注明原医疗器械注册证编号。
对于由低类别调整为高类别的产品,小编建议尽快按照变更后的管理类别向相应药品监督管理部门申请注册,在原二类产品按照新版《体外诊断试剂分类目录》注册为三类产品过程中,经常会遇到新的注册证还未办理完成,原有注册证已经到期的情形,在这种情况下,只要我们的产品安全有效且上市后未发生严重不良事件或质量事故,我们可以按原管理类别向原注册部门提出原医疗器械注册证延期申请,当然,这不是无期限的延期,延期后的证件有效期也不得超过2027年1月1日。
如果已经取得证件的产品,在医疗器械注册证有效期内发生注册变更,而产品管理类别又恰好发生了变化,那么是向原药品监督管理部门申请变更注册还是按照变化后的管理类别向相应药品监督管理部门申请变更注册呢?答案是向原注册部门申请变更注册,并且会在备注栏中注明新版《体外诊断试剂分类目录》中的管理类别。
对于第一类体外诊断试剂产品,我们要注意过渡时间有所不同,实施日期不再是2025年1月1日,而是2024年7月1日。
对于2024年7月1日前已备案的第一类体外诊断试剂产品,我们需要对照新版《体外诊断试剂分类目录》对备案信息及备案资料进行自查。
(1)如果备案信息不符合新版《体外诊断试剂分类目录》的描述,例如预期用途描述与与新版《体外诊断试剂分类目录》不一致,我们要及时进行变更备案。
(2)如果产品管理类别发生了变化,由低类别调整为高类别,我们应取消备案,并按照改变后的类别向相应药品监督管理部门申请注册。
值得注意的是,自2027年1月1日起,未依法取得注册证的,不得生产、进口和销售,在原备案有效期内生产的产品自2027年1月1日起也不得销售,这样看来,在证件有效期备足库存来应对证件失效的方式是行不通了。
以上是新版《体外诊断试剂分类目录》发布后,小编对已有证件的一些个人看法,对于拟取证产品的规定,比较简单,主要是时间节点的把握,这里不再赘述,文章最后,小编将如何进行注册备案管理的思维导图分享给大家参考。