原创干货 | IVD药物联合开发试验设计
2020-05-12 08:00:00source | 网络
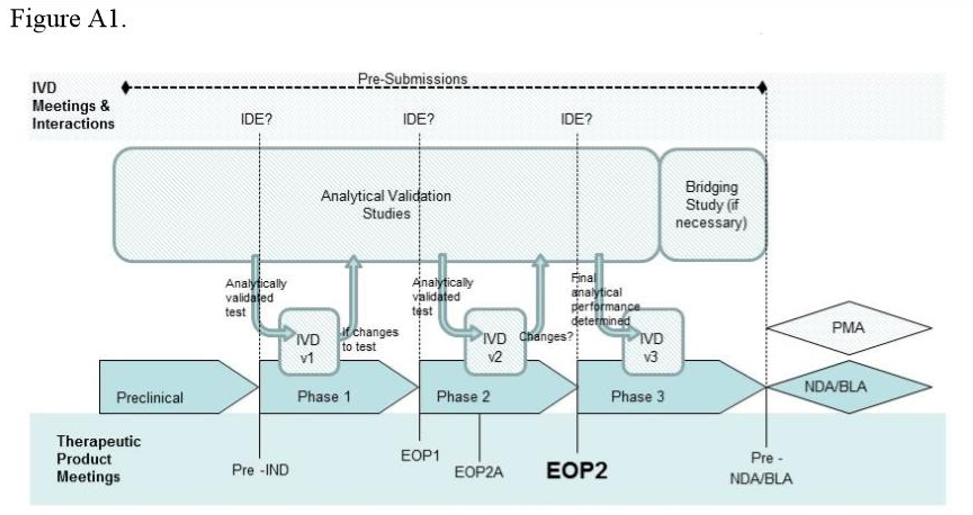
(一)试验设计方法
![]()
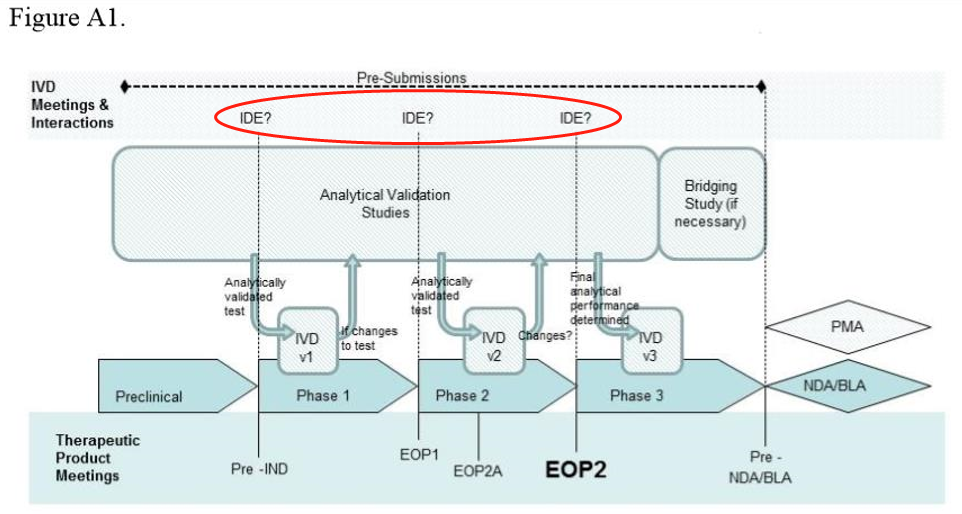
IDE regulation:
1. 豁免:提交IDE申请;
2. 有重要风险:提交IDE申请并收到批准;
3. 无重要风险:不需要提交IDE申请。
预筛选:筛选更可能对药物有反应的人群。
临床试验分析(CTA):通常是一个原型IVD,用于支持 受试者的选择或根据测试结果调查与结果相关的假设。
选择合适的marker:选择多个marker进行试验选择、确认合适的cutoff值,cutoff值用于决定药物受 试人群、剂量等。
合适的设计策略:
1. marker的特点;
2. 疾病的特点;
3. 药品的效果。
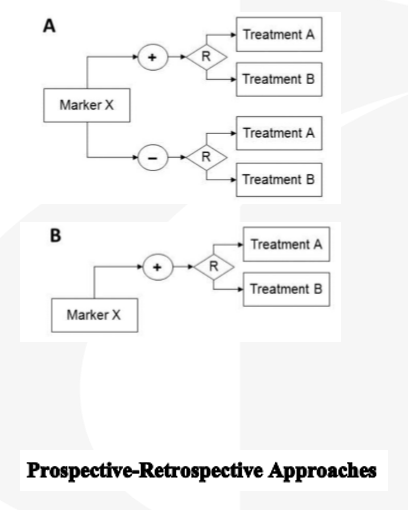
生物多样性或药物与生物标志物的关系未完全阐明, 试验结果与其他变量有关。
药物对marker阴性群体有害或缺乏有效性前瞻性收集样本+回顾性统计分析
> 无法根据marker状态对受试者分层,治疗有效性受限 ;
> 只适用于满足如下情况:
① 揭盲前已经规定主要有效性终点;
② 储存的样本来自充足的、质量好的研究;
③ 样本量足够大以至治疗效果可在marker决定的亚组中证实;
④ 试验结果可在大量的受试者中确定;
⑤ IVD具有可接受的分析效能;
⑥ FDA已经接受预先规定的分析计划;
⑦ 试验的使用者对试验结果不知情。
样本量考虑:
1. 主要有效性指标;
2. 药物治疗效果;
3. marker在人群中流行性的分析。

(二)实例分析
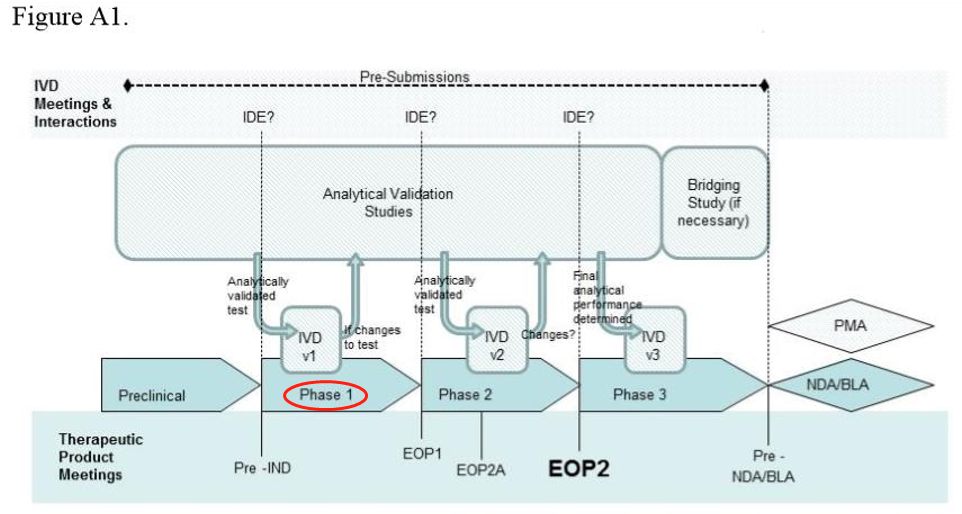
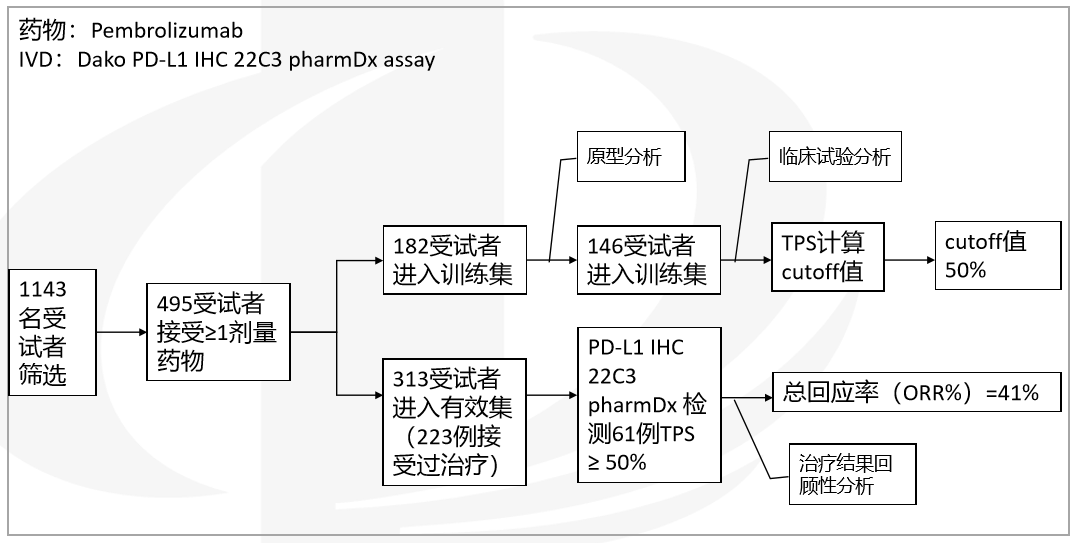
● 实例分析-phase 1
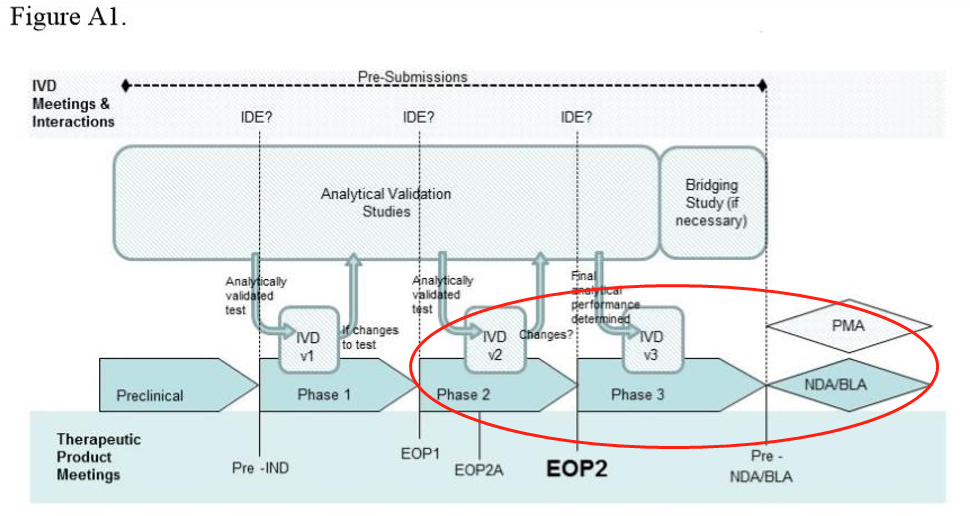
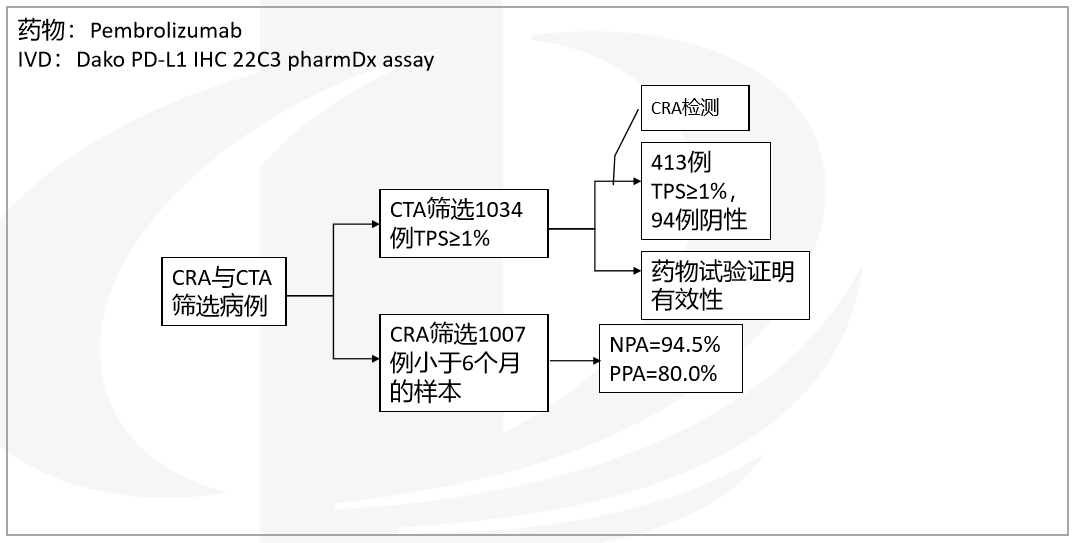
● 实例分析--phase 2、3
(三)国内要求
韩昭昭.伴随诊断类体外诊断试剂的临床试验研究浅析[J].诊断病理学杂志,2015,22(7):447-448,438.
研究方法:建议此类试剂的临床试验采用与药物联合评价的方式进行。采用以总缓解率等药品疗 效观察指标为判断标准,其中体外诊断试剂检测结果作为后继药物临床试验研究入组的判断标准。
临床试验机构选择:接受采用药品临床试验的常规做法,即多中心采样,在一家中心实验室进行检测,并以中心实验室结果为判断依据进行后继药品临床试验。值得注意的是,在进行药物联合 临床评价的同时,应在上述不少于3家临床试验机构同时进行体外诊断试剂检测,其检测结果用于 评价各床试验机构之间体外诊断试剂检测结果的一致性。对于采用全球多中心(其中包括中国临 床试验机构)形式进行的药品联合临床试验,还需在中国境内选择包括药品联合临床试验所在临 床试验机构在内,不少于3家临床试验机构。
临床试验方案:在试验操作过程中和判定检测结果时应采用双盲法以保证试验结果的客观性。
病例选择及样本要求:以药物适应症患者为研究对象,药物联合临床试验样本例数应符合《体外 诊断试剂临床研究技术指导原则》要求。如采用全球多中心形式进行药品联合临床试验,中国境 内样本例数也应符合《体外诊断试剂临床研究技术指导原则》要求。
统计结果分析:药物联合临床评价部分,以接受药物治疗后的临床试验数据及成功的客观应答率 等分析结果,判断伴随诊断类体外诊断试剂检测的安全性、有效性。
人表皮生长因子受体(EGFR)突变基因检测剂(PCR法)注册技术审查指导原则
基于细胞荧光原位杂交法的人类染色体异常检测试剂注册技术审查指导原则
免责声明 :以上内容的观点和意见,均为作者个人意见, 本内容属于个人知识产权,受中国版权法律保护,经许可方能使用,未经许可不得擅自使用。












