原创干货 | 体外诊断试剂临床试验设计要点
2020-05-08 17:00:00source | 网络
一、法规依据
临床试验法规依据
● 医疗器械监督管理条例(2014)
● 体外诊断试剂注册管理办法(2014)
● 体外诊断试剂注册管理办法修正案(2017)
● 体外诊断试剂注册管理办法(2020)
● 免于进行临床试验的体外诊断试剂同品种比对技术指导原则(征求意见稿)(2018)
● 体外诊断试剂临床试验技术指导原则(2014)
● 体外诊断试剂临床试验指导原则(征求意见稿)(2018)
● 接受医疗器械境外临床试验数据技术指导原则(2018)
● 具体被测物的指导原则
二、临床试验要求
临床试验基本原则 — 伦理原则
● 遵循《世界医学大会赫尔辛基宣言》的伦理学准则,保护受试者权益、安全、健康、 隐私。获得临床机构伦理委员会同意。
● 伦理考虑:样本获得带来的风险、试验结果带来的风险。
● 提交伦理委员会审查意见及知情同意书,或经审查免于知情同意。
临床试验基本原则 — 依法原则
● 机构和人员
◊ 三类3家;二类2家。
◊ 条件和能力(《医疗器械临床试验机构条件和备案管理办法》)
◊ 机构资质和人员 http://beian.cfdi.org.cn:9000/CTMDS/apps/pub/ylqxPublic.jsp
◊ 科室具有相关学科优势、检测能力,满足要求的设备条件等
◊ 统计学负责人应为相关专业背景和专业能力的人员
◊ 同期开展,多中心的需确定牵头单位,协调实施
● 方案和报告
◊ 方案由申办者与研究者共同制定,需经伦理委员会批准;
◊ 方案不得随意修改,严格遵循;
◊ 各机构分别出具分报告/分中心小结,牵头单位总报告。
临床试验基本原则 — 科学原则
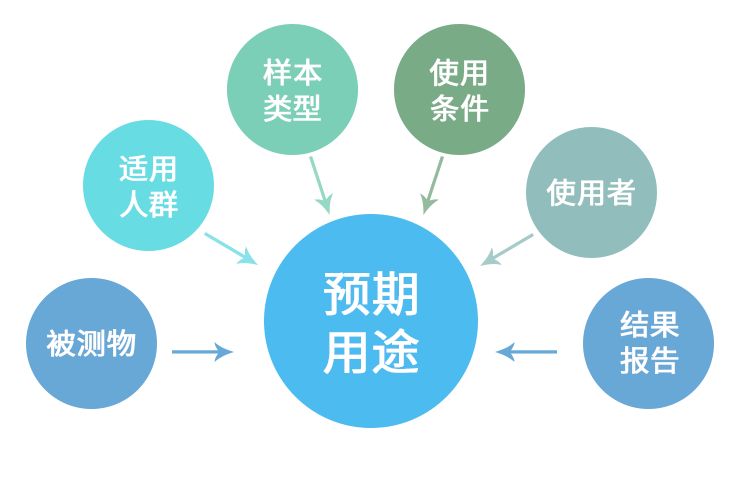
根据产品预期用途、适用人群、被测物特点和产品使用方法(如:使用者、结果解释、 样本类型)等进行科学的设计,包括选择适当的临床试验方法,确定适合的受试者选 择标准和临床评价指标等。
三、临床试验设计
设计类型
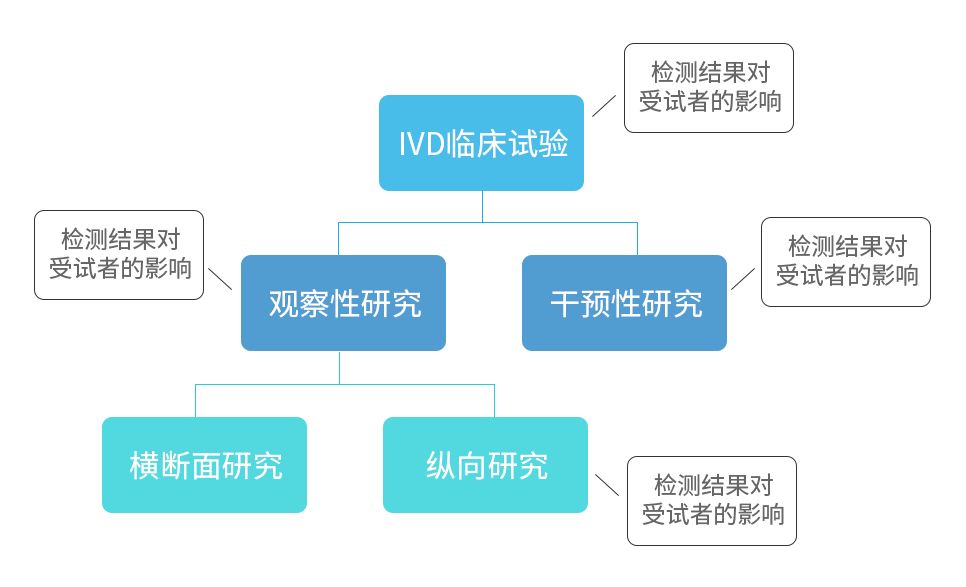
比较研究
● 目标:证明预期用途,明确受试人群、适应症
比较研究

对比方法选择
● 比较研究
◊ 考核试剂 vs 临床参考标准/对比试剂/实验室方法等
※确认产品临床性能
● 对比试剂
◊ 已上市同类产品;
◊ 具有可比性的产品:方法学、预期用途、性能指标、校准品量值溯源、推荐的阳 性判断值/参考区间、样本类型等。
※证明等效
● 临床参考标准
◊ 现有条件下临床上可获得的能够用来确定受试者目标状态(健康状态、疾病状态、疾 病进程、知道临床处置的疾病或健康状态等)的最佳方法,通常来自临床和实验室的医学 实践,包括:现有条件下公认的、可靠的、权威的疾病诊断标准(如组织病理学检查、影 像学检查、病原体分离培养鉴定、长期随访所得的结论等),疾病诊疗指南中明确的疾病 诊断方法,行业内的专家共识或临床上公认的、合理的参考方法等。
※证明检测结果与受试者目标状态的相关性
● 其他情形
◊ 临床参考标准 & 对比试剂
◊ 实验室参考方法
◊ 目前临床上不存在明确的临床参考标准、或临床参考标准尚不能全面评价产品临 床性能,同时境内亦无同类产品上市的情况。
● 举例(证明临床意义)
◊ 早期筛查:NIPT、HPV
◊ 指导用药:细菌耐药基因
◊ 伴随诊断:EGFR
受试者选择
● 根据预期用途、适用人群确定纳入、排除标准
● 受试者应来自产品预期用途所声称的适用人群(目标人群),如具有某种症状、 体征、生理、病理状态或某种流行病学背景等情况的人。
● 受试者应包括经临床参考标准确定具有某种目标状态的病例组和不具有目标状态 的对照组。病例组纳入标准应能够反映目标状态的全部特征,对照组需考虑纳入 可能对检测产生干扰的受试者、易与目标状态相混淆的疾病病例以及一定数量的 表观健康者。
● 受试者入组需根据产品特点考虑其他可能的影响因素,如不同民族、不同种族、 不同地域的影响等。
● 注重临界值样本或医学决定水平样本的选择,量值覆盖检测范围。
● 适当纳入干扰样本。
样本要求
● 前瞻性样本、回顾性样本
剩余样本≠回顾性样本
● 新鲜样本、冻存样本
● 建立剔除标准,样本不得随意剔除
评价指标和统计分析
● 要求:
◊ 方案中明确评价指标、统计方法及接受标准
◊ 统计建立在正确、完整的数据基础上
◊ 不应随意剔除数据
◊ 参考IVD产品指导原则要求
● 定性检测
◊ 评价指标:灵敏度(阳性符合率)、特异度(阴性符合率)、预测值、似然比等, 报告95%CI
◊ Kappa检验
◊ 不一致结果的原因分析

● 定量检测
◊ 回归分析(最小二乘法、Passing-Bablok、Deming)
◊ Bland-Altman分析
◊ 离群值的分析
● 可能涉及分层统计
◊ 人群亚组中基线特征
◊ 不同样本类型分别统计
◊ 多项联检、多基因型联检
◊ 检测范围较宽时分段统计
样本量
● 基本原则
◊ 符合法规最低样本量要求,符合IVD产品指导原则要求
◊ 临床试验样本量应满足统计学要求
考虑临床性能评价的各种因素对样 本量的要求,如:多种被测物、多种亚型、不同 受试者年龄段、不同疾病进程、干扰样本等涉及的亚组样本量的要求
● 不同样本类型的样本量要求
● 罕见病:参考相关指导原则
※满足临床性能评价的需要
偏倚的控制
● 盲法
● 同步检测/诊断
● 在临床试验全过程进行偏倚控制:机构选择、适用仪器选择、受试者选择、试验过程、 统计学分析等
◊ 例如:受试人群应尽可能代表目标人群的特征,以避免选择偏倚;不同临床试验 机构在临床试验中应统一试验操作和判读标准等,以避免中心效应的发生。
※减少引入偏倚,保证结果客观、真实、可靠
其他影响因素
体外诊断试剂的一些固有特征可能影响临床试验设计中的关键要素,在进行临床试验设 计时,应加以考虑,包括体外诊断试剂的检验原理、使用方法(包括对技能水平的要求 等)、使用条件(使用者和使用环境)、使用中人为因素的影响等。
例如:
1、消费者个人自行使用的体外诊断试剂:需考虑无医学背景使用者对产品说明书的认知 能力,并证明无医学背景使用者与专业检验人员检测结果的一致性。
2、体外诊断试剂的检测操作和数据处理、解读等对使用者有专门的技能要求时:临床试 验中对试验人员的技能水平、培训要求等应能够代表该产品上市后对预期使用者的要求。
免责声明 :以上内容的观点和意见,均为作者个人意见, 本内容属于个人知识产权,受中国版权法律保护,经许可方能使用,未经许可不得擅自使用。












