一文读懂!新政策下器械企业应如何应对医疗器械网络安全问题?
2022-07-14 08:49:42source | 网络

冯健 | 高级工程师
原全国医用电器标准化技术委员会放射治疗核医学和放射剂量学设备分技术委员会秘书长; 国家医疗器械技术审评专家库专家,国家医疗器械分类专家库专家,北京市科委专家; 制修订国家、行业标准13项,主持国家局《21医用软件》的分类子目录制修订、教材编写和培训工作,主持国家局《医用软件通用名称命名指导原则》编制工作; 参与国家十三五重大专题项目2项,获得“多模态配准测试方法和设备”等国家发明专利3项。
2022年3月,国家药监局器审中心发布《医疗器械网络安全注册审查指导原则(2022年修订版)》,顿时受到了绝大多数有源医疗器械制造商的热切关注。有源医疗器械(包括体外诊断医疗器械)大多由软件进行控制或者维护,包含不同形式的电子数据交换。
另外,随着人工智能软件,数字疗法软件以及远程医疗软件的迅猛发展,网络安全的问题日益突出,要求也进一步增加。
《医疗器械网络安全注册审查指导原则(2022年修订版)》对注册过程中需要提交的网络安全内容增加了更多细致和严格的要求,现就医疗器械网络安全问题做一下深入探讨。
▍ 01 医疗器械网络安全真的那么重要吗?
网络安全公司 Palo Alto Networks 近期对医院及其他医疗保健机构超过20万台智能输液泵进行了调查,发现75%的输液泵设备存在已知的安全漏洞,包括40种已知的安全漏洞/风险,以及IoT设备常见的70种缺陷。
这些安全漏洞一旦被非法使用,就可能危及患者生命或暴露患者的敏感数据。
由于医疗器械长期处于封闭简单的应用场景,因此产品在设计时强调设备的功能性及可用性,对安全性考虑不足,普遍存在安全漏洞且升级困难,通信协议缺少加密认证机制等安全隐患。黑客可以利用上述安全隐患对医疗器械进行攻击,造成医疗数据泄露、医疗事故甚至医院功能瘫痪等严重后果。
▍ 02 有的产品没有联网,单机版运行,甚至有的产品运行在PCB板上,这些产品也涉及到网络安全问题吗?
答案是肯定的。
医疗器械产品通过电子接口(如串口、并口、USB口、视频接口、音频接口,含调试接口、转接接口)或存储媒介(如光盘、移动硬盘、U盘)进行电子数据交换时,需要保证敏感医疗数据所含个人信息免于泄露、滥用和篡改,以及医疗数据和设备数据的有效隔离。
如果这些网络安全的措施没有进行设计、开发和实现,则产品很容易因为运行数据的破坏、医疗数据的流出等问题给企业带来巨大麻烦。
↘
例如,我们测试过一个设备,控制程序运行在计算机上。当电脑开机后,操作者可随意进入系统,找到存储患者数据的文件夹,将患者数据拷走。
另外,设备运行的重要参数使用txt文件保存,操作者可以随意更改和删除。这些问题将会导致产品在使用过程中的巨大风险,并由此带来严重的医疗事故。
▍ 03 新旧版网络安全审查指导原则有哪些变化?
新版指导原则对电子接口、数据接口、数据格式等进行了细致描述,增加了网络安全事件应急响应、全生命周期质控等内容。相比旧版指导原则,内容更加详实、要求更加具体,对于有效提高医疗器械网络安全具有重要指导意义。
☉ 主要变化如下:
1) 由19项网络安全能力变更为22项网络安全能力,增加了连通性(CONN)、现成软件清单(SBOM)、远程访问与控制(RMOT)。 2) 增加网络安全事件应急响应,要求制定网络安全事件应急响应预案,网络安全事件应急响应团队。 3) 增加重大网络安全更新判定原则,规定了影响到医疗器械的预期用途、使用场景或核心功能原则上均属于重大网络安全更新。 4) 增加全生命周期质控和生命周期过程的说明,不要求注册申请人单独建立医疗器械网络安全生存周期(又称生命周期)过程,而是将其作为医疗器械软件生存周期过程的重要组成部分予以整体考虑。 5) 增加医疗数据出境要求。 6) 增加远程维护与升级要求。 7) 增加遗留设备要求。 8) 增加现成软件网络安全研究资料、现成软件网络安全更新研究的要求。
▍ 04 指导原则规定了22项网络安全能力,如何识别产品的适用情况?
医疗器械产品种类繁多,差别较大,很难用一种统一的方法判断产品的网络安全能力。
水木医疗根据多年的经验,制作了网络安全基本信息表,通过对数据分类、接口分类、协议格式等方面进行逐条分解,与22项网络安全能力进行映射,就能快速分辨出产品的网络安全能力适用情况。
网络安全基本信息表如下图所示,仅供参考:
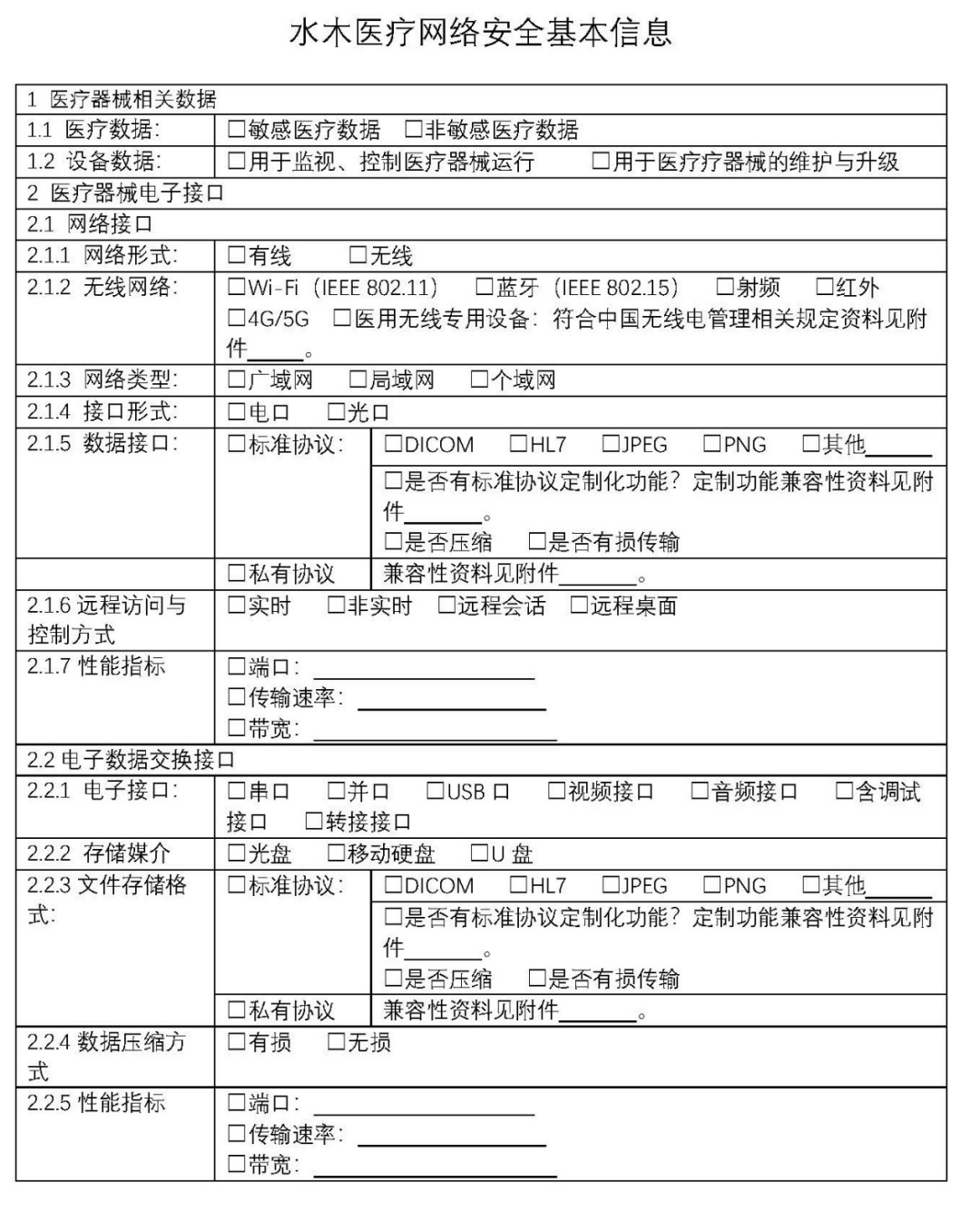
▍ 05 如何测试产品的网络安全能力?有没有参考方法和参考标准?
由于网络安全能力涉及的内容比较多,比较专业,有些测试还需要用到专业测评软件,因此建议企业到专业第三方实验室进行检测。
如果企业希望自行检测,可参考以下指导原则、指南和国际标准:
1)医疗器械网络安全注册审查指导原则(2022年修订版)
2)医疗器械网络安全审查指导原则实施指南(征求意见稿)(北京市药品监督管理局2019年第164号通知)
3)IECTR 80001-2-2 Application of risk management for IT-networks incorporating medical devices-Part 2-2: Guidance for the disclosure and communication for medical device security needs, risks and controls
4)IECTR 80001-2-8 Application of risk management for IT-networks incorporating medical devices-Part 2-8:Applicationguidance-Guidance on standards for establishing the security capabilities identified in IEC TR 80001-2-2
▍ 需要在产品研发的什么阶段考虑网络安全问题?
有源医疗器械制造商需要把网络安全提升到重要的战略高度,从设备研发立项和策划阶段,就要充分考虑网络安全的要求,避免在产品定型之后再进行设计更改和整改。
▍ 有没有途径可快速获得医疗器械产品网络安全的测试报告和研究资料?
水木医疗软件负责人通过近15年医疗器械检测经验总结,结合参与国家局《医疗器械网络安全注册审查指导原则(2022年修订版)》以及北京市局医疗器械网络安全审查指导原则实施指南编制的实际体会,制定出了一整套医疗器械网络安全相关的方案和实施细则,包括设计重点关注项目、网络安全基本信息表、网络安全检测项目(24大项,52小项)及检测方法、网络安全研究资料(即描述文档)编制方法、网络安全设计整改等,涵盖了医疗器械网络安全注册过程中所需要的所有资料,在努力提升产品网络安全能力的同时,快速提供网络安全合规资料,真正给企业带来专业化、高品质服务。












